病気について
脳腫瘍
脳の細胞や、脳・神経を包む膜の細胞などから発生する頭蓋内腫瘍の総称です。頭蓋内の原発腫瘍の他、他の癌からの転移性腫瘍もあります。また、頭蓋骨の底部である頭蓋底に発生する腫瘍のことを頭蓋底腫瘍と呼びます。当院では開頭手術だけでなく、経鼻内視鏡手術の症例も豊富で、耳鼻咽喉科や眼科、形成外科とも協力して手術を行なっております。また手術だけでなく、悪性脳腫瘍に対する免疫治療などの最先端治療も行なっております。
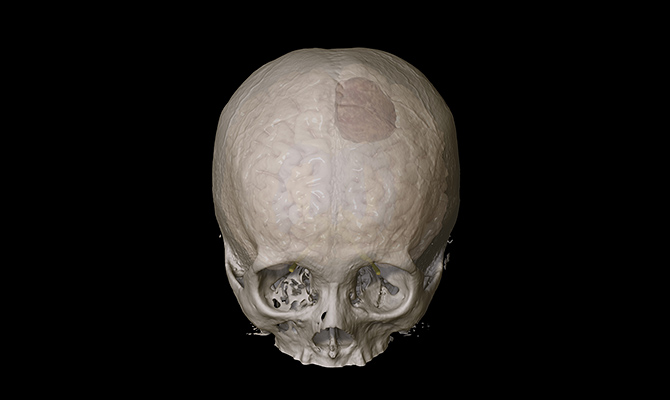
脳腫瘍の詳しい病気
病気について トップに戻る
病気について
脳の細胞や、脳・神経を包む膜の細胞などから発生する頭蓋内腫瘍の総称です。頭蓋内の原発腫瘍の他、他の癌からの転移性腫瘍もあります。また、頭蓋骨の底部である頭蓋底に発生する腫瘍のことを頭蓋底腫瘍と呼びます。当院では開頭手術だけでなく、経鼻内視鏡手術の症例も豊富で、耳鼻咽喉科や眼科、形成外科とも協力して手術を行なっております。また手術だけでなく、悪性脳腫瘍に対する免疫治療などの最先端治療も行なっております。
